MANTENIMIENTO PREVENTIVO Y CORRECTIVO A SUS EQUIPOS DE LABORATORIO
CAPACITACIONES TÉCNICAS ESPECIALIZADAS
nuestros servicios
Contamos con un equipo especializado con mas de 20 años de experiencia profesional
Validación de áreas blancas / Servicios de calificación de cabinas de bioseguridad y flujo laminar y aire comprimido

Objetivo
Demostrar mediante evidencia documentada la calificación de diseño (DQ), la calificación de instalación (IQ), la calificación de operación (OQ) y la calificación de desempeño (PQ) del sistema de ventilación de los cuartos limpios y zonas limpias con ambientes controlados asociados cumplen con las especificaciones predeterminadas para la normatividad vigente ISO 14644-1 (2015), las GMP o las especificaciones según lo indique el cliente.
Alcance:
Calificar la Operación y Desempeño del sistema de ventilación para las áreas limpias o zonas clasificadas para grados ISO 1 a ISO 9 o áreas Grados A, B, C y D.
Ensayo:
- Integridad de filtros HEPA
- Medición de caudales en filtros, rejillas de inyección y extracción
- Medición de los diferenciales de presión y sentido de flujo del aire
- Conteo de partículas no viables (Clasificación de áreas)
- Tiempo de recuperación en áreas (Recovery time)
- Temperatura y humedad relativa en áreas (donde aplique)
- Visualización del flujo de aire (Airflow visualization)
- Medición de velocidad en motores
Equipos:
- Fotómetro: Prueba de integridad filtros HEPA.
- Multímetro: Medición de velocidad de aire, caudal de aire y diferenciales de presión entre áreas, sentido de flujo del aire.
- Contador de partículas no viables: Conteo de partículas no viables para clasificación de ambientes, tiempo de recuperación.
- Termohigrómetro y/o Datalogger: Medir temperatura y humedad relativa del área.
- Generador de partículas: Generador de partículas usadas para la prueba de integridad y tiempos de recuperación.
- Video Cámara: Visualización del flujo de aire.
- Tacómetro digital: Medición de velocidad en motores.
Bibliográfica y criterios de aceptación:
- Resolución 1160 del 6 de abril de 2016.
- ISO 14644-1:2015 Cleanrooms and associated controlled environments —Part 1
- ISO 14644-3:2005 Cleanrooms and associated controlled environments —Part 3
- OMS Informe 45, Anexo 6
- Guía ISO 1822-4:2009 High-efficiency air Filter (EPA, HEPA and ULPA). Numeral 8.5.4
Validación de sistemas computarizados y hojas de calculo
Las empresas del sector farmacéutico utilizan una serie de aplicaciones para la gestión de su negocio como sistemas ERP, gestores documentales o sistemas de laboratorio.
La validación de sistemas informáticos es un requisito que deben completar las empresas del sector para cumplir con la normativa aplicable y conseguir las autorizaciones y certificaciones necesarias. A su vez, realizar dicha validación también aporta otros beneficios que permiten mejorar la productividad, aumentar los niveles de fiabilidad y seguridad y, en definitiva, proporcionar mejores productos con un menor coste de desarrollo.
La validación de sistemas informáticos es un procedimiento que garantiza que una aplicación o sistema informático cumple con las buenas prácticas de fabricación, por lo que se garantiza la calidad de sus procesos informáticos.
La validación es el proceso de revisión al que se somete el sistema informático para comprobar que cumple con todas sus especificaciones y es capaz de realizar su cometido en cumplimiento con la normativa aplicable y el uso esperado por el usuario regulado. Además, la validación de sistemas informatizados no se limita únicamente a las aplicaciones o programas, sino que también se aplica al funcionamiento del hardware y a la integración en tiempo real de dispositivos móviles.
Beneficios de la validación de sistemas informáticos:
La validación de sistemas informáticos en el sector farmacéutico no tiene como único objetivo cumplir con las normativas estándares existentes, sino que aporta una serie de beneficios a las empresas del sector regulado farmacias y laboratorios como son:
Los datos que manejan las empresas del sector regulado están relacionados con pacientes y medicamentos, por lo que son considerados como sensibles. La validación de sistemas informáticos garantiza la fiabilidad de esos datos y su integridad durante todo el ciclo de vida (no serán modificados de forma incontrolada).
Se tendrá un control de la información a medida que avanza el proceso, evitando pérdidas de datos, fraudes y cualquier otro incidente que comprometa los datos, permitiendo cumplir con los requerimientos en auditorías de certificación o requerimientos legales.
Tener toda la información sobre los recursos facilita una mejor gestión y control sobre los costes. Además, permite eliminar o automatizar todas aquellas actividades que no añadan valor (generación de tickets manuales, escaneos, impresiones y procesos similares), con el consiguiente ahorro de tiempo y reducción de costes.
Los errores que se producen en la documentación de la producción pueden acarrear serios problemas de salud a los pacientes y un deterioro de la imagen de una farmacéutica. La validación permite disponer de un sistema que previene la aparición de este tipo de errores de gran impacto.
Con flujos de trabajo bien definidos y la estandarización de procesos se agilizan los procesos, evitando retrasos y eliminando la aparición de fallos o errores.
Los sistemas informáticos deben ser dinámicos, disponiendo de fórmulas de revisión constante de procesos y corrección de errores que permitan una mejora continua.
Con la validación se consigue que los sistemas informáticos aporten transparencia en los procesos de fabricación, distribución y comercialización de medicamentos (con el uso de la firma digital, por ejemplo).

¿Qué sistemas informáticos deben validarse?
Como norma general, se debe validar todo sistema informatizado que tenga impacto sobre las actividades de producción de medicamentos o productos sanitarios y, por lo tanto, que pueda afectar a la calidad del producto final, la seguridad del paciente y la integridad de los datos generados.
La validación de sistemas afecta a las actividades descritas dentro de los siguientes conceptos:
- Buena Práctica Clínica (BPC o GCP en inglés).
- Buenas Prácticas de Laboratorio (BPL o GLP en inglés).
- Normas de correcta fabricación (NCF o GMP en inglés).
- Buenas Prácticas de Distribución (BPD o GDP en inglés).
- Buena Práctica de Farmacovigilancia (GVP).
No todos los sistemas informáticos requieren de una validación, sin embargo, esta validación toma gran relevancia en otras aplicaciones, entre las que podemos destacar:
- Sistemas de ERP (Enterprise Resource Planning).
- Sistemas de gestión de almacén, SGA.
- Gestión de sistemas de laboratorio, LIMS.
- Gestores Documentales, EDMS.
- Sistemas de control de fabricación, MES.
- Sistemas de supervisión, control y registros, SCADA.
- Sistemas de laboratorio para control analítico.
- Sistemas de farmacovigilancia.
- Business Intelligence.
¿Cómo validar un sistema informático?
Para conseguir la validación de los sistemas informáticos de una empresa, y que estos cumplan con los requisitos normativos exigibles, INGMETRO como empresa especializada dispone de las herramientas y los sistemas adecuados de auditoria y validación de sistemas informáticos.
La validación de un sistema informático debe comenzar desde su diseño, confeccionando un documento (URS) donde se indican los requerimientos de usuarios o uso previsto por el usuario.
La información que se recoge en este documento es de vital importancia para el desarrollo de las actividades posteriores y realizar la validación según las normas internacionales. Estas actividades son, de forma resumida, las siguientes:
Informe que garantiza que el diseño propuesto por el suministrado de la aplicación cumple con los requisitos regulatorios, los requisitos técnicos, los requisitos operativos y el propósito para el que es concebido (intended use).
Evaluación de los potenciales riesgos que tengan afectación directa o indirecta sobre la calidad del producto, seguridad del paciente e integridad de los datos. De este análisis se obtiene el alcance de las actividades de validación posteriores.
Se trata de la verificación técnica de que la instalación ha sido realizada según el diseño calificado.
Verifica que los sistemas y equipos, tal como se han instalado o modificado, funcionan de la manera deseada en todas las circunstancias de funcionamiento previstas y cumplen con la normativa aplicable para el proceso y sistema.
Es la comprobación documental que se realiza tras la OQ, y mide si el sistema funciona de forma aceptable bajo condiciones normales operativas.
El ciclo de vida de la validación del software
Empieza con la especificación de los requisitos y la planificación del diseño (recogido en el plan maestro de validación). Luego se realiza la implementación e instalación de los sistemas y se realizan pruebas y tests para comprobar el buen funcionamiento, y poder aplicar modificaciones y añadir nuevas funciones.
Durante todo el proceso de validación de sistemas informáticos debe llevarse un control estricto de la documentación e informes generados en cada una de las etapas de validación, y las comprobaciones realizadas deben ser llevadas a cabo por profesionales distintos a los que implementaron el sistema.
¿Qué normativas están vinculadas a la validación?
La validación de sistemas informáticos en empresas del sector regulado debe cumplir con las siguientes normativas y guias según el mercado en el que se fabriquen y comercializen sus productos:
Medicamentos de uso humano y veterinario
- 21 CFR Part 11 – Electronic Records; Electronic Signatures.
- EU GMP Annex 11 – Cumputerised System Validation.
- EU GMP Annex 15 – Validation and Qualification.
- ISPE GAMP 5: A Risk-Based Approach to Compliant GxP Computerized Systems.
- ISPE GAMP Guide: Records and Data Integrity.
- WHO: Guidance of good data and record management.
- FDA: Data Integrity and Compliance with cGMP Guidance for Industry.
Producto sanitario
- ISO 13485: 2016
- ISO/TR 80002-2:2017
- Directiva 90/385/CEE
- Directiva 93/42/CEE
- Directiva 98/79/CE
- REGULATION (EU) 2017/745
- REGULATION (EU) 2017/746
- 21 CFR Part 820
La validación de los sistemas informatizados le proporciona al sector farmacéutico y de producto sanitario, una garantía del correcto funcionamiento de su sistema.
La validación de los sistemas informatizados supone el abandono de sistemas de carácter departamental o del tipo bases de datos, hojas de cálculo, o similares, optando por una solución que integre todos los procesos en un único sistema informático.
Aparte de cumplir con la normativa, la validación de sistemas informáticos aporta a las empresas del sector muchas otras ventajas relacionadas con el aumento de la calidad, el control, seguridad y transparencia de la información que tienen como resultado una reducción de los errores.
La validación garantiza formalmente que el sistema opere de forma controlada, segura y transparente por lo que se aporta calidad al proceso global.
Mapeos térmicos
Para cumplir con el requerimiento normativo de buenas practicas de almacenamiento y conocer la homogeneidad y estabilidad de sus bodegas, cuartos de almacenamiento y cuartos fríos o con condiciones controladas de humedad y temperatura, bajo especificaciones Technical supplement to WHO Technical Report Series, No. 961, 2011
INGMETRO entrega con el informe de servicio:
- El layout de la bodega
- Levantamiento isométrico con la ubicación de los sensores
- Datos máximos y mínimos encontrados durante la prueba
Se garantiza la seguridad en la toma y el tratamiento de datos de los mapeos, bajo directiva CFR 21 Parte 11 de FDA
Calificación de equipos de laboratorios
Calificación.
Operación por la que se comprueba que un equipo funciona correctamente y produce realmente los resultados previstos. La calificación es parte de la validación, pero las etapas de calificación por separado no suponen ninguna validación de procesos (Guía de Buenas Prácticas de Fabricación, parte I)
Etapas en la calificación de equipos
Anexo 15, Guía BPM
La verificación documentada de que el diseño propuesto para las instalaciones, los sistemas y los equipos es adecuado para la finalidad prevista.
La verificación documentada de que las instalaciones, los sistemas y los equipos, tal y como se han instalado o modificado, cumplen con el diseño aprobado y con las recomendaciones del fabricante.
La verificación documentada de que las instalaciones, los sistemas y los equipos, tal y como se han instalado o modificado, funcionan de la manera deseada en todos los rangos de funcionamiento previstos.
La verificación documentada de que los sistemas y los equipos, pueden funcionar de forma efectiva y reproducible de acuerdo al método de proceso aprobado y a las especificaciones del producto.
Normatividad asociada
- Parenteral Drug Association (PDA), en el sector farmacéutico.
- UK Pharmaceutical Industry.
- Health Sciences Authority (HSA) en el sector salud.
- European Norme 285.
- US Food and Drug Administration (FDA).
Mantenimiento preventivo y correctivo a equipos de laboratorio
Tenemos dentro de nuestro equipo de trabajo ingenieros y técnicos especializados, con capacidad de diagnosticar y realizar mantenimientos preventivos y correctivos, de la mayoría de equipos e instrumentos de medición usados en laboratorios de control de calidad, laboratorios de medición, ensayos y productivos.
Además, INGMETRO ofrece la posibilidad de repotenciar sus equipos antiguos o con tecnología obsoleta, entregando nuevos planos eléctricos y de diseño en el informe que se realice.

Capacitación y asesorías técnicas
Adquiere los conocimientos, herramientas, habilidades y actitudes para interactuar en el entorno laboral y cumplir con el trabajo que se les encomienda.
- Curso teórico práctico en volumetría, presión y electroquímica
- Aseguramiento metrológico
- Metrológia básica
- Determinación de intervalos de calibración
- Estimación de incertidumbre en métodos de ensayo y medición
- Validación y parametrización de hojas de excel
- Validación de sistemas computarizados bajo GAMP 5 y CFR 21 parte 11
- Cursos teóricos prácticos en volumen, presión, temperatura, tiempo y frecuencia
- Curso teórico practico en mapeos térmicos
Capacitándose con nosotros obtendrás
Certificado de asistencia
Capacitaciones Teórico - prácticas
Memorias digitales del evento
Procedimientos y formatos utilizados en la capacitación
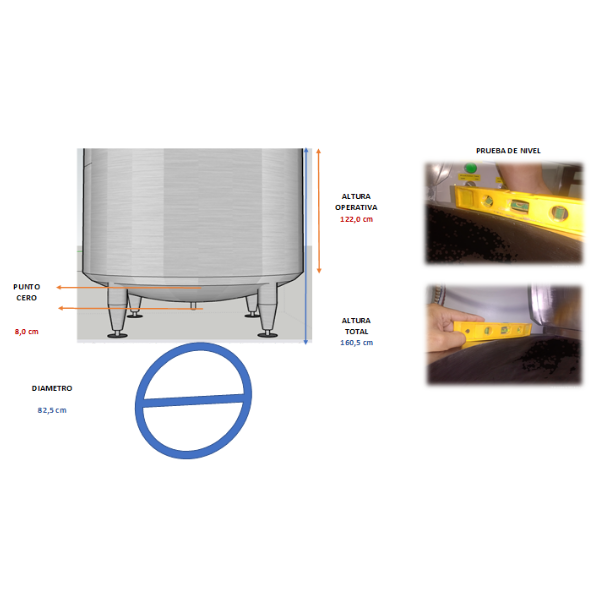
Aforo de tanques
Por método volumétrico
Con ayuda de un caudalímetro o flujómetro calibrado, trazable a laboratorios acreditados nacionales o internacionales y utilizando el agua como fluido de referencia, con alcance desde 100 litros hasta 10.000 litros según la norma ISO-4269 (API 2555).
OPCIONAL: instalación de sistema electrónico para las mediciones parciales y nominales del tanque
Por método grávimétrico
Realizado con balanza o bascula calibrada con alcance hasta 90 litros

Caracterización de medios isotérmicos
Califiación de instalación, operación y desempeño (IQ, OQ, PQ) bajo requerimientos USP o caracterización según UNE-EN-60068-3-5. Con alcance para:
- Estufas
- Cámaras
- Incubadoras
- Baños térmicos
- Neveras
- Congeladores
Desarrollo de software a la medida para la administración del aseguramiento metrológico
Desde INGMETRO estamos en capacidad de realizar según sus necesidades, el software o las aplicaciones que mas requiera según sus procesos de aseguramiento metrológico.
Tenemos a su disposición software comerciales con código cerrado, que permita la administración de los equipos e instrumentos de medición, en donde cada uno de los usuarios registrados puede acceder a la hoja de vida de cada equipo o instrumento de la compañía, en donde se pueden ver y administrar las actividades relacionadas con los mantenimientos preventivos y correctivos, las calibraciones o calificaciones y la historia desde la compra que cada uno de ellos tenga.
Desarrollar de la mano con nuestros programadores aliados, aplicaciones o software a la medida que les permita administrar los diferentes equipos e instrumentos de cada uno de nuestros clientes.
Los software desarrollados por INGMETRO SAS se entregan con los respectivos manuales de usuario y validación, con el fin de cumplir con los diferentes requerimientos normativos.

Consultoría
- Servicios de ingeniería.
- Diseño de salas limpias.
- Gestión de instalaciones.
- Mantenimiento de líneas de producción.
- Gestión de mantenimiento.
- Soluciones integrales de los procesos.
Proyectos de Capital
- Diseño arquitectónico.
- Ingeniería estructural.
- Portafolio de Capex.
- Preparación de casos de negocio.
- Gestión de proyectos.
- Administración del trabajo.


Calibración y automatización
- Calibración de Instrumentos.
- Automatización de procesos.
- Validación de sistemas informáticos.
- Integración de sistemas SCADA.
- Actualización de equipos obsoletos.
Edificios y Propiedades
- Planificación del mantenimiento.
- Mantenimiento de infraestructura.
- Sistemas de gestión de edificios.
- Administración de CMMS (software que ayuda a gestionar activos, programar mantenimientos y realizar un seguimiento de las órdenes de trabajo).
- Proyectos de ahorro de energía.
- Operación y mantenimiento en depuradoras de aguas residuales (EDARs)


Investigaciones y solución de problemas
- Investigaciones de errores humanos.
- Evaluaciones de riesgos de calidad.
- Búsqueda de la causa raíz.
- CAPA.
- Mejora Continua /RFT - Seis Sigma
Mejora Continua /RFT - Seis Sigma
- Procesos de manufactura de Líquidos, Solidos, Estériles
- Procesos Empaques.
- Equipos de fabricación y Laboratorio.
- Sistemas de apoyo críticos.
- Sistemas Computarizados .

Si desean mayor información o visita sin costo
Uno de nuestros asesores lo contactará para definir una cita o asesoría técnica.
Dirección
Carrera 61 # 77Sur - 27, Edificio Venecia P.H, Local 214, La Estrella - Antioquia, Colombia
Celular / WhatsApp
+57 302 241 2972
comercial1@ingmetro.com